Trong hóa học, Anken là một khái niệm cơ bản của hóa học hữu cơ – hidrocacbon không no. Khi nắm rõ các khái niệm về tính chất vật lý, tính chất hóa học của nó bạn sẽ có nền tảng vững chắc để dễ dàng chinh phục hóa hữu cơ. Hãy cùng Reviewedu tìm hiểu về Anken là gì? Phản ứng đặc trưng của Anken, cấu tạo hóa học,… thông qua bài viết dưới đây.
Anken là gì? Cấu tạo hóa học của anken
Đầu tiên, ta cùng tìm hiểu Anken là gì và cấu tạo hóa học cũng như danh pháp của chúng.
Anken là gì?
Anken hay Olefin/Vinyl là một loại hiđrocacbon không no thuộc hóa học hữu cơ chứa hai nguyên tố H và O trong phân tử.
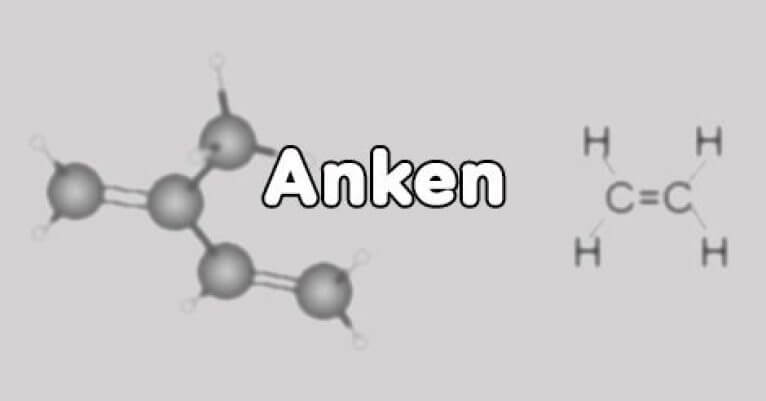
Cấu tạo hóa học của Anken
Về phần cấu tạo, Anken có đặc điểm khác với các hidrocacbon không no khác. Trong phân tử của Anken có chứa các liên kết đơn, 1 liên kết đôi C=C và là dạng mạch hở.
Công thức chung: CnH2n (n ≥ 2)
Công thức anken đơn giản nhất của Anken là etilen (CH2 = CH2)
Danh pháp của Anken
Mỗi loại Anken có cấu tạo hóa học khác nhau thì có tên gọi khác nhau nên để đọc được tên của các Anken, thường áp dụng những cách sau đây:
- Tên thông thường = Tên Ankan – đổi đuôi “an” thành “ilen”
Ví dụ: CH2 = CH2 là Etilen; CH2 = CH–CH3 là Propilen
- Tên thay thế = số chỉ vị trí nhánh – tên nhánh – tên mạch chính – số chỉ vị trí liên kết đôi – en
Lưu ý: Chọn mạch chính là mạch C dài nhất có chứa liên kết đôi
Đánh số CC mạch chính từ vị trí gần liên kết đôi nhất
Ví dụ:
- CH2 = CH2: Eten; CH3 – CH = CH – CH3: But-2-en
Đồng phân
Anken có các loại đồng phân như sau:
- Đồng phân xicloankan (n≥3)
- Đồng phân vị trí liên kết đôi (n≥4)
- Đồng phân mạch Cacbon chính
- Đồng phân hình học gồm đồng phân cis và đồng phân trans
- Đồng phân cis: mạch C chính cùng một phía của mặt phẳng chứa liên kết pi
- Đồng phân trans: mạch C chính ở khác phía của mặt phẳng chứa liên kết pi
Các tính chất hóa học của anken
Liên kết π ở nối đôi ở Anken kém bền vững, nên trong phản ứng dễ bị đứt ra để tạo liên kết σ với các nguyên tử khác gây ra những phản ứng hóa học đặc trưng Anken như: Phản ứng cộng, phản ứng trùng hợp, phản ứng oxi hóa và phản ứng thế Clo.
Phản ứng cộng
Phản ứng cộng là phản ứng đặc trưng nhất của Anken. Phân tử hợp chất hữu cơ sẽ kết hợp phân tử khác tạo nên phân tử hợp chất mới. Có các loại phản ứng cộng như: Cộng hidro, cộng brom, cộng dung dịch halogen,…
Cộng hidro
Phương trình phản ứng tổng quát:
CnH2n + H2 → CnH2n+2 (Ni, t0)
Anken Ankan
Đặc điểm của phản ứng cộng H2 vào Anken:
- Tỉ khối của hỗn hợp khí sau phản ứng bao giờ cũng tăng (do số mol khí giảm còn khối lượng thì không đổi).
- Số mol khí giảm của hỗn hợp sau so với trước phản ứng bằng số mol H2 đã tham gia phản ứng. Chú ý áp dụng bảo toàn khối lượng, bảo toàn H, bảo toàn C.
Cộng dung dịch Br2: Đây cũng là cách nhận biết Anken
CnH2n + Br2 → CnH2nBr2
(nâu đỏ) (không màu)
Phản ứng cộng HX (H2O/H+, HCl, HBr…)
CnH2n + HX → CnH2n+1X
Chú ý:
Phản ứng cộng HX vào anken bất đối tạo ra hỗn hợp 2 sản phẩm.
Sản phẩm chính của phản ứng cộng được xác định theo quy tắc cộng Maccopnhicop: Nguyên tử H sẽ gắn với nguyên tử cacbon ở liên kết đôi có nhiều H hơn, X gắn với C ít H hơn.
Phản ứng trùng hợp
Phản ứng trùng hợp là quá trình cộng liên tiếp nhiều phân tử nhỏ có cấu tạo giống nhau để tạo ra phân tử lớn gọi là polyme.
Sơ đồ phản ứng trùng hợp:
nA → (B)n (t0, xt, p)
Tên B = polime + tên monome (nếu tên monome gồm nhiều từ thì đặt trong ngoặc).
nCH2=CH2 → (-CH2–CH2-)n (Polietylen hay PE)
nCH2=CH–CH3 → (-CH2–CH(CH3)-)n (Polipropilen hay PP)
Phản ứng oxi hóa
Oxi hóa hoàn toàn
Phương trình tổng quát:
CnH2n + 3n/2O2 → nCO2 + nH2O
Đặc điểm phản ứng đốt cháy anken: nCO2 = nH2O.
Oxi hóa không hoàn toàn
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n(OH)2 + 2KOH + 2MnO2
Riêng CH2=CH2 còn có phản ứng oxi hóa không hoàn toàn tạo CH3CHO.
CH2=CH2 + 1/2O2 → CH3CHO (PdCl2, CuCl2, t0)
Trong một số trường hợp oxi hóa không hoàn toàn sẽ có thể làm mất màu thuốc tím, vậy nên đây cũng là cách để nhận biết Anken.
Phản ứng thế clo
Các phản ứng thế Cl vào anken xảy ra trong điều kiện nhiệt độ cao (từ 450 – 5500C).
Sản phẩm chính ưu tiên thế vào H của C no gắn với C không no (vị trí alyl).
CH2=CH2 + Cl2 → CH2=CHCl + HCl
CH2=CH-CH3 + Cl2 → CH2=CH-CH2Cl + HCl

Phản ứng đặc trưng của anken là gì?
Phản ứng đặc trưng của anken là phản ứng cộng. Bởi trong phân tử anken có liên kết đôi π; liên kết này kém bền hơn so với liên kết đơn σ. Ngoài ra, chúng còn có phản ứng trùng hợp và phản ứng oxi hóa.
Những đồng đẳng của anken
Etilen (CH2 = CH2) và các chất tiếp theo có công thức phân tử C3H6 C4H8, C5H10,… có tính chất tương tự Etilen lập thành dãy đồng đẳng có công thức phân tử chung CnH2n (n > 2) được gọi là Anken hay Olefin.
Phương pháp điều chế anken
Có nhiều cách điều chế Anken trong phòng thí nghiệm và trong công nghiệp hằng ngày như:
- Trong phòng thí nghiệm: Người ta thường tách được Anken hoặc đồng phân và nước từ các hợp chất ancol. Với xúc tác và axit H2SO4 đặc và nhiệt độ trên 170oC
- Trong công nghiệp: C2H2n có thể được thu thập từ nguồn khí khi chế biến dầu mỏ hoặc dùng các phương pháp tách từ hợp chất ankan hoặc ancol để tiết kiệm chi phí và sinh ra được nhiều sản phẩm hơn.
Kết luận
Tên gọi Anken có vẻ nghe xa lạ nhưng chúng ta lại tiếp xúc với nó hằng ngày phổ biến nhất là Etilen hay còn gọi là rượu và nhiều ứng dụng khác dùng để chế tạo nhựa, giấm, axit hữu cơ,… Mong rằng, với những chia sẻ trên đây của Reviewedu sẽ giúp các bạn phần nào nắm được kiến thức cơ bản Anken là gì? Phản ứng đặc trưng của Anken, cấu tạo hóa học của Anken,…
Xem thêm:
Hiện tượng thủy triều đỏ là gì? Nguyên nhân và tác hại của hiện tượng thủy triều đỏ
Hiện tượng phản xạ ánh sáng là gì? Phân loại và định luật của hiện tượng phản xạ ánh sáng
Tiền tệ là gì? Tiền tệ xuất hiện khi nào? Bản chất, chức năng và lịch sử ra đời của tiền tệ
Quầng mặt trời là gì? Hiện tượng vòng tròn quanh mặt trời có mang đến điềm xấu hay không?




